秋水仙素处理美丽胡枝子的多倍体诱导研究
李伟1 胡冬南2 李慧1 陈晓阳1
1. 生命科学学院生物工程,北京林业大学,北京市 100083,P.R.China
2. 园林艺术学院,江西农业大学,南昌市 330045,P.R.China
摘要:通过不同浓度的秋水仙素溶液处理美丽胡枝子的种子、子叶和顶芽进行多倍体诱导。美丽胡枝子多倍体的形体变异和染色体数目也被分析。研究结果表明:这最好的多倍体诱导材料是美丽胡枝子种子萌发的顶芽在秋水仙素浓度为0.1%处理36小时,多倍体诱导率可达到44.4%。与正常二倍体植物相比较,该多倍体植物在我们试验中表现为植株矮小、茎短、叶厚、叶大。细胞学的研究表明加倍过的幼苗它的形态发生了引人注目的明显改变,具有四套染色体,其体细胞染色体条数为44(2n=4x=44)。
关键词:美丽胡枝子,秋水仙素,多倍体诱导,形体变异
1 介绍
胡枝子属植物在分类学上属于豆科类植物,是常见的多年生落叶灌木植物,分布在温带和亚热带这两个地区,喜光照,抗性强,并且拥有一个先进的根部系统,容易在受损后根能再生和根能快速增长。另一方面胡枝子属物种也作为一种高产饲料资源用于牲畜如牛、马、羊和兔子的喂养中在中国西部地区,也可以被作为蜂蜜采蜜的蜜源植物,因为它的花期长能够获得高产量。
一般来说,在中国各种各样的胡枝子属资源的重要性没有得到完全的认识。没有专门生产胡枝子这种特殊饲料的临时基地,也没有筛选出能够带来高收益和高品质的新型的胡枝子属物种或理想的胡枝子属物种。因此,问题在于如何提高胡枝子属植物的生产质量用来作为一种饲料来源。胡枝子属植物多倍体育种法则是可以通过同时扩大营养器官的染色体剂量效应和提高压力电阻的一种十分有效的植物育种法。因此对胡枝子属植物的分枝和叶片进行多倍体诱导培养从而获得能够提高收率的胡枝子属植物是一个至关重要的方法。迄今为止在很多农作物以及桑树和杨树育种中多倍体育种取得了很大的进展,但是迄今为止没有相关专门研究胡枝子属植物多倍体育种的报告。
2.材料与方法
2.1材料
从美国密西西比州引种的美丽胡枝子。
2.2试剂
试验用到的试剂:秋水仙素溶液;卡诺液(乙醇:乙酸=1:3);70%的乙醇,分解液;45%乙酸;卡宝品红染色液。
2.3方法
美丽胡枝子的三种材料被选定,分别是:种子,子叶和顶芽。我们挑选出200个测试个体作为每个处理组进行试验,但是我们分析方法不包括被污染的个体。
2.3.1对种子的多倍体诱导
秋水仙素浓度和处理时间关系:建立六组不同秋水仙素浓度的处理组,六组处理组依次编号为1、2、3、4、5、6,且依次用0.4%、0.2%、0.1%、0.05%、0.025%、0.01%的秋水仙素处理三个时间段(24、36、48小时)。
处理方法:种子处理包括用无菌水清洗和干燥种子,接着把种子放入70%的乙醇溶液1分钟,再用无菌水对种子清洗2到3次,用1%的化学水银对种子进行6分钟的消毒,再用无菌水清洗5到6次种子,最后在60摄氏度的无菌水中浸泡24小时后进行最后一次无菌水冲洗。
诱导方法:把消毒后弄干燥的种子放入6个不同秋水仙素浓度(灭菌过滤过)进行处理,然后放进一个MS培养基,要求是无菌环境。
2.3.2对子叶的多倍体诱导
处理子叶的方法与处理种子的方法一样。
处理方法:无菌种子被放进一个MS培养基中。种子发芽后削减子叶并均匀放入带有六种不同浓度的秋水仙素的变异MS培养基(MS+2. 0 mg/L 2. 4—D+1.0 mg/L 6—BA)。处理环境要求是无菌环境,一周后,在全天光照条件下培养6个连续时间段:0、2、4、6、8和10天。
2.3.3对顶芽(茎尖)的多倍体诱导
处理种子的方法是将种子用无菌水浸泡12到24小时,再用70%的乙醇溶液浸泡一分钟,用无菌水清洗,接着用2%的次氯酸纳搅拌浸泡20分钟。最后放入MS培养基进行无菌培养。
诱导处理:种子萌发成幼苗后,我们把浸泡不同浓度秋水仙素的消毒棉球与顶芽裹好处理两个时间段(24和36小时),再取下棉球将顶芽连同子叶一并剪下置于在MS培养基中培养20天后我们削减子叶留顶芽后放在一个新的MS培养基中进行繁殖种苗。
2.4染色体检测
为得到最好的结果,染色体检测最好选厚的叶片和枝条的体细胞的有丝分裂阶段在显微镜下观察,这种染色体检测方法我们参考陈的(1982)。
3结果与分析
3.1多倍体诱导
3.1.1种子的多倍体诱导
1)外形
在不同秋水仙素浓度和处理时间不同,而生长15天的种子有明显的变化,在处理24小时,六种不同浓度秋水仙素处理下没明显差别。在处理36小时,有明显差别,第1、2组基本停止生长根也发黄。第3组5%的生长缓慢,节间比正常生长的短。第4组处理近一半生长慢,节间短,另一半正常生长。第5、6组95%生长正常。浸泡48小时的6个组表现也不一样,第1,2,3组处理均停止生长,根变褐色,第4组处理大部分生长很慢,节间短,少数生长正常,第5,6组处理生长正常。
2)染色体检测
取各处理植株的茎尖进行细胞学镜检,处理24小时的6个组没有发现加倍细胞;浸泡36小时仅有第一组0.4%处理95%种子的细胞发生加倍,可观察到很多染色体数加倍的中期分裂相,第2、3组处理的70%种子的细胞的染色体明显增多,但加倍的染色体分散的中期分裂相很少,秋水仙素浓度更小的4,5,6组处理细胞都没有加倍;浸泡48小时的第1,2,3组超过50%的细胞发生加倍,第4组处理有10%细胞发生加倍,第5组则只有5%发生加倍,最后组无加倍细胞。
3)继代培养
将第1,2,3,4组分别处理36小时和48小时8个处理生长10天的幼苗的茎尖带子叶接种在MS培养基上,培养中发现第1组两个时间段和第2组的48小时以及第3组的48小时4种处理的茎尖不生长,另外4种处理的茎尖均有不生长、生长慢和生长正常3种情况。
3.1.2子叶的多倍体诱导
结果表明,在一样的黑暗和光照环境下,子叶的愈伤组织在MS培养基中并且没有秋水仙素的补充情况下,第6组处理了两天长出了子叶芽,而第4,5组则在MS培养基中补充秋水仙素4天才长出。
3.1.3茎尖的多倍体诱导
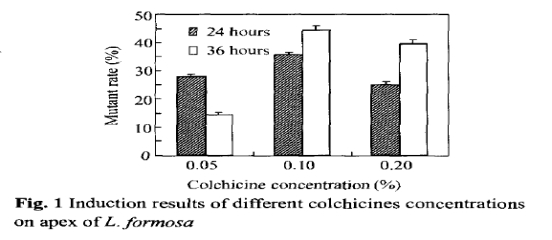
图1是关于秋水仙素浓度分别为0.05%,0.10%,0.20%处理24和36小时的诱导率,最高的是在0.10%处理36小时情况下高达44.4%
3.2多倍体植株的形态变异与鉴定
图2和3可以看出多倍体植株与二倍体种子培育的植株相比形态有明显的变化,变现为加倍体茎较粗短,叶片较肥厚宽大,色泽更深绿。
图2二倍体植株 图3加倍植株
3.3染色体
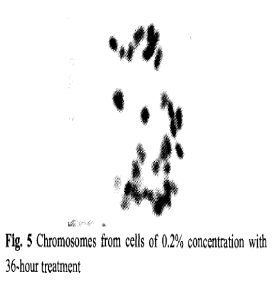
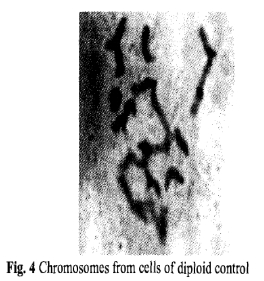 通过观察秋水仙素浓度为0.10%和0.20%处理36小时的茎尖的染色体数目(图4,5和6),可以证实多倍体含有更多的染色体数目,多倍体植株的染色体数目大多接近2n=4x=44,有一些植株的染色体则超过4倍,还发现有很少一些是二倍体(2n=22)细胞。图5和6结果表明在秋水仙素浓度为0.10%处理的茎尖所加倍的比在0.20%下多的多。
通过观察秋水仙素浓度为0.10%和0.20%处理36小时的茎尖的染色体数目(图4,5和6),可以证实多倍体含有更多的染色体数目,多倍体植株的染色体数目大多接近2n=4x=44,有一些植株的染色体则超过4倍,还发现有很少一些是二倍体(2n=22)细胞。图5和6结果表明在秋水仙素浓度为0.10%处理的茎尖所加倍的比在0.20%下多的多。
图4二倍体细胞的染色体 图5秋水仙素0.20%处理36小时的细胞染色体
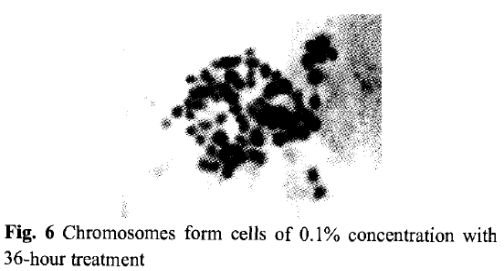
图6秋水仙素0.10%处理36小时的细胞染色体
4结果与讨论
4.1比较多倍体诱导方法
种子,子叶和萌发种子的茎尖作为材料来诱导美丽胡枝子的多倍体是能成功的,它们各有个的优势。但诱导种子所获得的植株中仍有部分二倍体细胞,这种既有四倍体细胞又有二倍体细胞的嵌合体在后续的增殖过程中极易恢复为二倍体。
子叶也能通过愈伤组织来获得多倍体诱导,但和处理种子一样存在后边增殖会恢复二倍体的可能性。而且需要大量秋水仙素,少量的诱导率很低。
茎尖加倍后得到的细胞倍性一致,观察结果要么二倍体,四倍体或更高多倍体。采用棉球滴浸法处理茎尖是诱导美丽胡枝子较为理想的途径。
4.2多倍体诱导时间
一般来说,秋水仙素诱导多倍体的处理时间不低于24小时。秋水仙素浓度高时处理时间要短一些,浓度低时处理时间长一些。如用浓度为0.2%的秋水仙素处理24小时或36小时和浓度为0.1%的秋水仙素处理36小时的诱导效果是一样的。
4.3多倍体诱导选择阶段
对于用秋水仙素诱导多倍体来说选择细胞分化的阶段是一个关键的因素。秋水仙素对有丝分裂中期的细胞效果最好。因此适当的秋水仙素浓度处理适当的细胞分裂阶段能取得显著的影响效果。新生的幼苗具有处于许多有丝分裂的细胞。当这些幼苗生长中,秋水仙素处理过的幼苗将生长缓慢,用含有秋水仙素的卫生棉条处理茎尖前后放入MS培养基培养。
4.4多倍体幼苗的前景
所有的多倍体和四倍体幼苗已经明确形态变异和不同数量的染色体条数。最初检测染色体是在显微镜下,但进一步的研究应该是否有必要对这些多倍体植株进行提纯而不是形态特征来判断,当它们长大后,实地试验是未来进一步调查的前提,选择多倍体植株营养器官通过组织分离来形成稳定的四倍体物种自花授粉。